|
ANTICUERPOS
Los anticuerpos constituyen glucoproteínas
plasmáticas globulares, llamadas
Inmunoglobulinas. Son moléculas formadas
por los linfocitos B maduros. La
función del anticuerpo
consiste en unirse al antígeno y
presentarlo a células efectoras del
sistema inmune. Esta función está
relacionada con la
estructura de los distintos
tipos de inmunoglobulinas.
Estructura de las Inmunoglobulinas
Son proteínas globulares de
gran peso molecular, formadas por 4 cadenas
polipeptídicas, dos pesadas, llamadas
H (heavy), y dos ligeras,
denominadas L (light). Estas
cadenas se unen mediante puentes disulfuro,
uno entre las cadenas L y H, y dos entre las
cadenas H. Estas cadenas proteicas presentan
radicales glucídicos.
Existen dos tipos de cadenas
L (l
y
k) y
cinco tipos de cadenas H (a,
d, e, g y
m),
que dan lugar a los cinco isótopos de
inmunoglobulina existentes (A,
D,
E,
G
y
M).
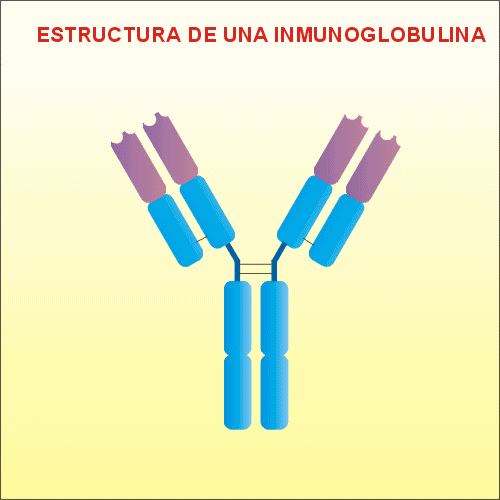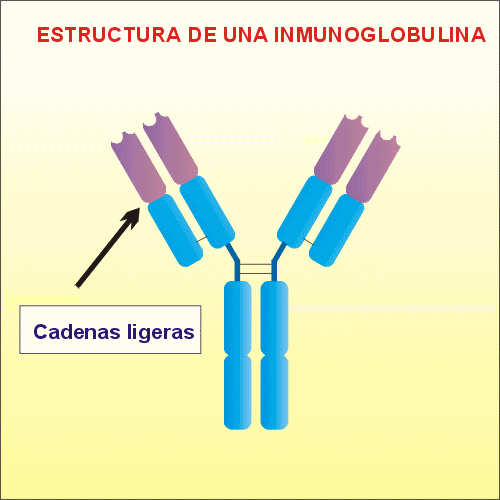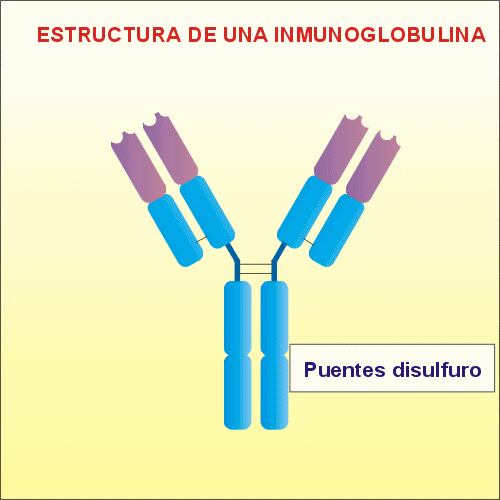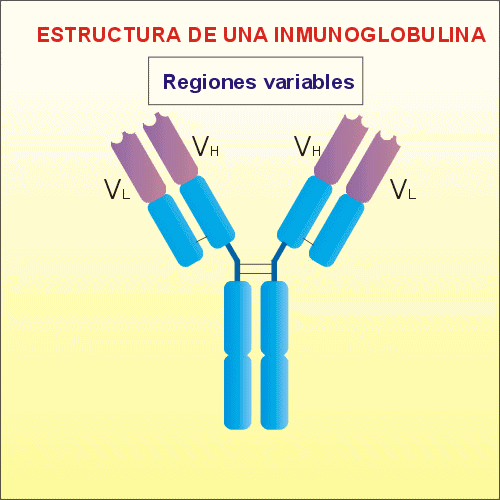
Las cadenas H y L presentan
dos regiones, o dominios, diferenciados: el
dominio variable, V, y el dominio
constante, C. El dominio variable es el
responsable de reconocer al antígeno y
unirse a él, ya que ahí se encuentra el
paratopo. El dominio constante se une a
las células del sistema inmune para
activarlas.
En las cadenas H aparece una
zona denominada región bisagra. Esta
región posee la característica de ser muy
flexible, permitiendo adquirir distintos
ángulos entre las regiones V y C, y entre
los brazos de la inmunoglobulina.
 |
|
Existe una gran variedad
de anticuerpos, tantos como antígenos.
Esta gran variedad se obtiene como
consecuencia de la reordenación y la
mutación de los genes que codifican
la región V.
-
La reordenación, o
recombinación somática, es un mecanismo
que sólo ocurre en un momento temprano del
desarrollo de los linfocitos B. Los genes
que codifican para la región V y C, que se
encuentran separados en todas las células,
se reordenan para juntarse , en el caso de
los linfocitos B. Cuando estos genes se
juntan reciben el nombre de segmentos
génicos. Los segmentos génicos pueden
combinarse entre sí, llegando a generar,
aproximadamente 3.400.000 regiones V
distintas. Esta gran variedad de
combinaciones recibe el nombre de
diversidad combinatorial.
-
La mutación, o
hipermutación somática, que se produce
en esta zona del material genético
corresponde a adiciones o sustracciones de
bases nitrogenadas en los segmentos génicos
que codifican para la región V.
|
Todas estas variaciones
pueden generar una inmunoglobulina no
funcional. Cuando se producen este tipo de
reordenaciones se habla de reordenamiento
no productivo.
El proceso de recombinación y
mutación está muy regulado, de forma que
cada linfocito B sólo expresa un gen
reordenado de la cadena H y otro de la
cadena L. Así, cada linfocito produce
un único tipo de anticuerpo.
Tipos
de inmunoglobulinas
Los isótopos de
inmunoglobulina que aparecen en la especie
humana son las inmunoglobulinas A,
D,
E,
G
y
M.
|
-
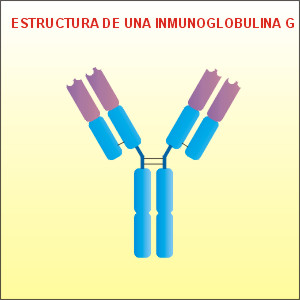
Inmunoglobulina G: Es
la más abundante (80% del total de
inmunoglobulinas). Se une rápidamente con
macrófagos y neutrófilos, provocando la
destrucción del microorganismo. Puede
atravesar la barrera placentaria y se
secreta en la leche materna. Por ello, es
responsable de la inmunidad fetal y la del
recién nacido.
|
|
 |
|
-
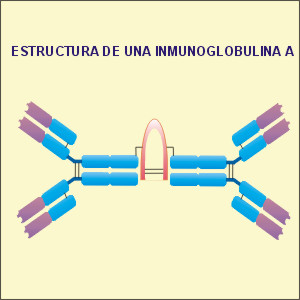
Inmunoglobulina A:
corresponde al 13% del total de
inmunoglobulinas. Se encuentra
específicamente en secreciones serosas y
mucosas, como son la leche o las
lágrimas. Actúa protegiendo la superficie
corporal y los conductos secretores. Genera,
junto con la inmunoglobulina G, la inmunidad
al recién nacido, al encontrarse en la
leche.
|
|
 |
|
|
|
 |
|
-
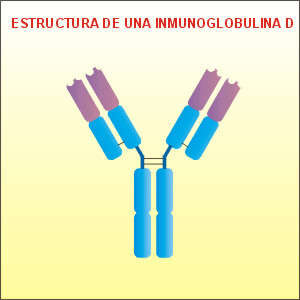
Inmunoglobulina D:
aparece en muy baja concentración (1%). Son
las primeras inmunoglobulinas sintetizadas
por los linfocitos B naïve. Su función puede
estar relacionada con la activación de estas
células. Su estructura es similar a la
estructura de la inmunoglobulina G, aunque
varía en la posición de los restos
glucosídicos de las cadenas proteicas.
|
|
 |
|
|
|
 |
Funciones de las inmunoglobulinas
La principal función de los
anticuerpos consiste en reconocer y
unirse al antígeno, para la destrucción
de éste. Para conseguir este fin, el dominio
constante de la inmunoglobulina puede
activar los siguientes mecanismos:
-
Activación del sistema del
complemento, que termina con la lisis
del microorganismo.
-
Opsonización de los
microorganismos. Los anticuerpos se unen
al antígeno, presentándolo a un macrófago
para su destrucción.
-
Precipitación de toxinas
disueltas en el plasma. Así, son
fácilmente destruidas por los macrófagos.
-
Aglutinación de antígenos en
una determinada zona, facilitando la acción
de los fagocitos y los linfocitos.
-
Activación de linfocitos.
|